- Biển số
- OF-359543
- Ngày cấp bằng
- 23/3/15
- Số km
- 1,310
- Động cơ
- 266,613 Mã lực
BÀI SỐ 559 : ĐIỀU TRỊ UNG THƯ PHỔI TẾ BÀO NHỎ CHƯA BAO GIỜ LẠC QUAN NHƯ LÚC NÀY KHI CÓ SỰ THAM GIA CỦA CÁC DÒNG THUỐC KHÁNG THỂ LIÊN HỢP !
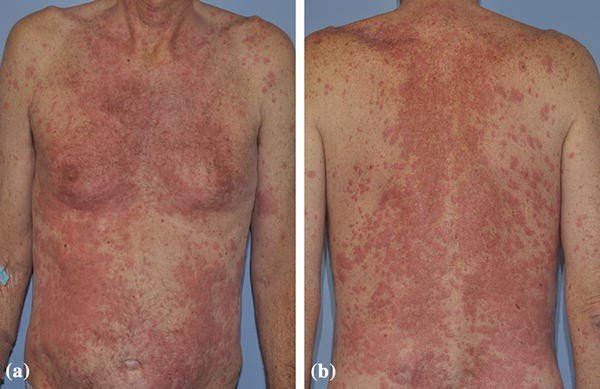
1. Vào tháng 3/2025, Chuyên gia Yuxiang Ma cùng các đồng nghiệp đã công bố kết quả của nghiên cứu NCT05434234.
Nghiên cứu NCT05434234 được thiết kế ở phase1 trên quy mô toàn cầu nhằm đánh giá hiệu quả của Thuốc kháng thể liên hợp YL201 khi điều trị cho những bệnh nhân ung thư thể rắn giai đoạn tiến triển KHÔNG CÒN ĐÁP ỨNG với các phác đồ điều trị tiêu chuẩn ( một dạng hết bài ).
Tổng cộng 312 bệnh nhân trong đó bao gồm cả bệnh nhân ung thư phổi tế bào nhỏ giai đoạn lan tràn và bệnh nhân ung thư phổi không tế bào nhỏ đã được tuyển vô nghiên cứu.
Kết quả phân tích cho thấy :
=>> Tỷ lệ đáp ứng khách quan của Thuốc kháng thể liên hợp YL201 khi điều trị cho nhóm bệnh nhân ung thư phổi tế bào nhỏ giai đoạn lan tràn đạt 63.9%. ( cực kỳ ấn tượng !!! ).
=>> Tỷ lệ đáp ứng khách quan của Thuốc kháng thể liên hợp YL201 khi điều trị cho nhóm bệnh nhân ung thư phổi ko tế bào nhỏ dạng biểu mô tuyến đạt 28.6%.
Thừa thắng xông lên, nghiên cứu hiện đã được mở rộng quy mô sang phase3.
2. Một điều cần nói thêm là Thuốc kháng thể liên hợp YL201 do Tập đoàn MediLink có trụ sở chính tại Tô Châu Trung Quốc nghiên cứu và phát triển. Trước đó vào ngày 18/12/2024 Thuốc kháng thể liên hợp YL201 cũng đã được Cục quản lý thực phẩm dược phẩm Hoa Kỳ FDA cấp Chỉ Định Thuốc Mồ Côi trong điều trị ung thư phổi tế bào nhỏ !
Cứ theo đà này, hai từ Tàn Khốc khi nhắc đến ung thư phổi tế bào nhỏ sẽ sớm được loại bỏ thôi.
Mong lắm thay !

 www.facebook.com
www.facebook.com
1. Vào tháng 3/2025, Chuyên gia Yuxiang Ma cùng các đồng nghiệp đã công bố kết quả của nghiên cứu NCT05434234.
Nghiên cứu NCT05434234 được thiết kế ở phase1 trên quy mô toàn cầu nhằm đánh giá hiệu quả của Thuốc kháng thể liên hợp YL201 khi điều trị cho những bệnh nhân ung thư thể rắn giai đoạn tiến triển KHÔNG CÒN ĐÁP ỨNG với các phác đồ điều trị tiêu chuẩn ( một dạng hết bài ).
Tổng cộng 312 bệnh nhân trong đó bao gồm cả bệnh nhân ung thư phổi tế bào nhỏ giai đoạn lan tràn và bệnh nhân ung thư phổi không tế bào nhỏ đã được tuyển vô nghiên cứu.
Kết quả phân tích cho thấy :
=>> Tỷ lệ đáp ứng khách quan của Thuốc kháng thể liên hợp YL201 khi điều trị cho nhóm bệnh nhân ung thư phổi tế bào nhỏ giai đoạn lan tràn đạt 63.9%. ( cực kỳ ấn tượng !!! ).
=>> Tỷ lệ đáp ứng khách quan của Thuốc kháng thể liên hợp YL201 khi điều trị cho nhóm bệnh nhân ung thư phổi ko tế bào nhỏ dạng biểu mô tuyến đạt 28.6%.
Thừa thắng xông lên, nghiên cứu hiện đã được mở rộng quy mô sang phase3.
2. Một điều cần nói thêm là Thuốc kháng thể liên hợp YL201 do Tập đoàn MediLink có trụ sở chính tại Tô Châu Trung Quốc nghiên cứu và phát triển. Trước đó vào ngày 18/12/2024 Thuốc kháng thể liên hợp YL201 cũng đã được Cục quản lý thực phẩm dược phẩm Hoa Kỳ FDA cấp Chỉ Định Thuốc Mồ Côi trong điều trị ung thư phổi tế bào nhỏ !
Cứ theo đà này, hai từ Tàn Khốc khi nhắc đến ung thư phổi tế bào nhỏ sẽ sớm được loại bỏ thôi.
Mong lắm thay !

CHIẾN THẮNG UNG THƯ PHỔI | Facebook
CẬP NHẬT NHỮNG TIẾN BỘ MỚI NHẤT TRÊN THẾ GIỚI VỀ UNG THƯ PHỔI.
 www.facebook.com
www.facebook.com