- Biển số
- OF-359543
- Ngày cấp bằng
- 23/3/15
- Số km
- 1,310
- Động cơ
- 266,613 Mã lực
BÀI SỐ 692 : CHUẨN BỊ CÓ TIÊU CHUẨN ĐIỀU TRỊ MỚI DÀNH CHO NHỮNG BỆNH NHÂN UNG THƯ PHỔI KHÔNG TẾ BÀO NHỎ DƯƠNG TÍNH BỘC LỘ MIỄN DỊCH PDL1 !!!
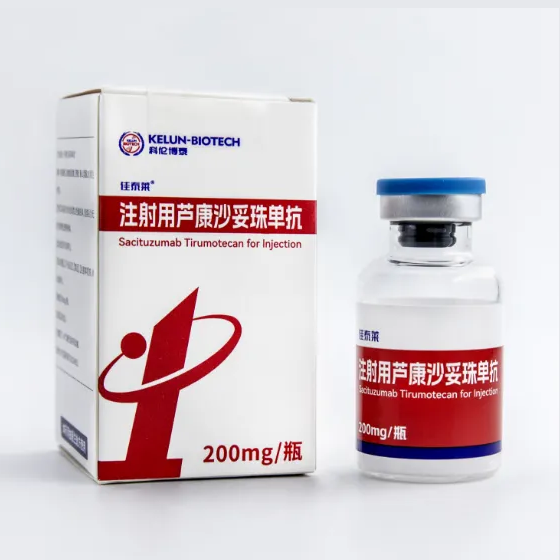
1. Cách đây 4 tháng, khi bàn về tham vọng muốn vẽ lại mọi ngóc ngách trong điều trị ung thư phổi của Thuốc kháng thể liên hợp Sacituzumab Tirumotecan, mình có từng nhắc đến mục tiêu trở thành tiêu chuẩn điều trị cho nhóm bệnh nhân DƯƠNG TÍNH bộc lộ miễn dịch PDL1.
Tin vui là việc này sắp trở thành hiện thực !
2. Cách đây chưa đầy 24 tiếng, tức vào ngày 24/11/2025, Tập đoàn Sichuan Kelun-Biotech đã ra thông cáo báo chí về dữ liệu mới nhất của nghiên cứu OptiTROP-Lung05.
Nghiên cứu OptiTROP-Lung05 được thiết kế NGẪU NHIÊN tại phase3 nhằm so sánh đối đầu giữa phác đồ gộp Thuốc Sacituzumab Tirumotecan + Thuốc miễn dịch Pembrolizumab với Thuốc miễn dịch Pembrolizumab đơn độc khi điều trị BƯỚC ĐẦU cho những bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn di căn hoặc tiến triển cục bộ DƯƠNG TÍNH bộc lộ miễn dịch PDL1 ( >= 1% ). Nghiên cứu được thực hiện trên 406 bệnh nhân.
Kết quả cho thấy :
=>> Phác đồ gộp Thuốc Sacituzumab Tirumotecan + Thuốc miễn dịch Pembrolizumab cho CẢI THIỆN ĐÁNG KỂ thời gian sống không bệnh tiến triển khi so với phác đồ Thuốc miễn dịch Pembrolizumab đơn độc.
=>> Mặc dù dữ liệu hiện chưa hoàn thiện, nhưng phân tích tạm thời cho thấy phác đồ gộp Thuốc Sacituzumab Tirumotecan + Thuốc miễn dịch Pembrolizumab có xu hướng CẢI THIỆN thời gian sống còn toàn bộ khi so với phác đồ Thuốc miễn dịch Pembrolizumab đơn độc.
Đây là một cột mốc lịch sử, khi nó đánh dấu LẦN ĐẦU TIÊN một chiến lược gộp Thuốc kháng thể liên hợp + Thuốc miễn dịch đem lại kết quả thành công khi đối đầu với tiêu chuẩn cũ.
Hiện chỉ tính riêng trong ung thư phổi, Thuốc kháng thể liên hợp Sacituzumab Tirumotecan đang được đánh giá trong 10 nghiên cứu, bao gồm 5 nghiên cứu tại Trung Quốc và 5 nghiên cứu có quy mô toàn cầu.
Dòng thuốc kháng thể liên hợp đang đem lại những thay đổi ko thể tưởng tượng được trong ung thư nói chung và trong ung thư phổi nói riêng !

 www.facebook.com
www.facebook.com
1. Cách đây 4 tháng, khi bàn về tham vọng muốn vẽ lại mọi ngóc ngách trong điều trị ung thư phổi của Thuốc kháng thể liên hợp Sacituzumab Tirumotecan, mình có từng nhắc đến mục tiêu trở thành tiêu chuẩn điều trị cho nhóm bệnh nhân DƯƠNG TÍNH bộc lộ miễn dịch PDL1.
Tin vui là việc này sắp trở thành hiện thực !
2. Cách đây chưa đầy 24 tiếng, tức vào ngày 24/11/2025, Tập đoàn Sichuan Kelun-Biotech đã ra thông cáo báo chí về dữ liệu mới nhất của nghiên cứu OptiTROP-Lung05.
Nghiên cứu OptiTROP-Lung05 được thiết kế NGẪU NHIÊN tại phase3 nhằm so sánh đối đầu giữa phác đồ gộp Thuốc Sacituzumab Tirumotecan + Thuốc miễn dịch Pembrolizumab với Thuốc miễn dịch Pembrolizumab đơn độc khi điều trị BƯỚC ĐẦU cho những bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn di căn hoặc tiến triển cục bộ DƯƠNG TÍNH bộc lộ miễn dịch PDL1 ( >= 1% ). Nghiên cứu được thực hiện trên 406 bệnh nhân.
Kết quả cho thấy :
=>> Phác đồ gộp Thuốc Sacituzumab Tirumotecan + Thuốc miễn dịch Pembrolizumab cho CẢI THIỆN ĐÁNG KỂ thời gian sống không bệnh tiến triển khi so với phác đồ Thuốc miễn dịch Pembrolizumab đơn độc.
=>> Mặc dù dữ liệu hiện chưa hoàn thiện, nhưng phân tích tạm thời cho thấy phác đồ gộp Thuốc Sacituzumab Tirumotecan + Thuốc miễn dịch Pembrolizumab có xu hướng CẢI THIỆN thời gian sống còn toàn bộ khi so với phác đồ Thuốc miễn dịch Pembrolizumab đơn độc.
Đây là một cột mốc lịch sử, khi nó đánh dấu LẦN ĐẦU TIÊN một chiến lược gộp Thuốc kháng thể liên hợp + Thuốc miễn dịch đem lại kết quả thành công khi đối đầu với tiêu chuẩn cũ.
Hiện chỉ tính riêng trong ung thư phổi, Thuốc kháng thể liên hợp Sacituzumab Tirumotecan đang được đánh giá trong 10 nghiên cứu, bao gồm 5 nghiên cứu tại Trung Quốc và 5 nghiên cứu có quy mô toàn cầu.
Dòng thuốc kháng thể liên hợp đang đem lại những thay đổi ko thể tưởng tượng được trong ung thư nói chung và trong ung thư phổi nói riêng !

CHIẾN THẮNG UNG THƯ PHỔI | Facebook
CẬP NHẬT NHỮNG TIẾN BỘ MỚI NHẤT TRÊN THẾ GIỚI VỀ UNG THƯ PHỔI.
 www.facebook.com
www.facebook.com